Интенсификация электроосаждения сплава цинк-никель из аммонийного электролита
Аннотация
Изучены закономерности электроосаждения цинк-никелевого сплава в электролитах, содержащих коллоидные частицы электроосаждаемых металлов. Разработан электролит, который позволяет уменьшить концентрации основных компонентов в 2 раза и увеличить скорость процесса в 2,5 раза.
Ключевые слова: сплав цинк-никель, коллоидные частицы, скорость электроосаждения
05.17.03 - Технология электрохимических процессов и защита от коррозии
Интенсификация процессов электроосаждения металлов позволяет, не увеличивая производственных площадей, существенно повысить объем выпускаемой продукции и производительность труда. Существуют различные способы интенсификации процессов электроосаждения покрытий: увеличение концентрации ионов электроосаждаемых металлов, перемешивание электролита, применение нестационарных режимов электролиза и ультразвука. Однако они являются экономически неэффективными, так как требуют дополнительных затрат на материальные и энергетические ресурсы. Повысить скорость процесса электроосаждения металлов позволяет использование электролитов-коллоидов. В них скорость нанесения покрытий на порядок и более выше, чем в простых и комплексных электролитах, электролиз проводится без подогрева, а концентрации основных компонентов значительно ниже, чем в электролитах, используемых в промышленности. Из электролитов, содержащих коллоидные частицы разряжающихся металлов, осаждаются блестящие и полублестящие покрытия, обладающие улучшенными физико-механическими свойствами [1].
Для электроосаждения сплава цинк-никель в промышленности используется электролит состава, г/л: оксид цинка 15, хлорид никеля шестиводный 90, хлорид аммония 230 – 250 и борная кислота 20. Рабочая температура электролита 40 оС, диапазон плотностей тока 0,5 – 2,0 А/дм2. Величина рН 6,8 – 7,0. В нем осаждаются покрытия сплавом с содержанием 15 – 25 % никеля. Коррозионная стойкость таких покрытий выше, чем у чистого цинка. Выход по току сплава 93 – 96 % [2]. В процессе электролиза вследствие выделения водорода происходит подщелачивание прикатодного слоя, в результате которого образуются труднорастворимые соединения цинка и никеля, на основе которых могут формироваться коллоидные частицы. Обеспечив участие этих частиц в процессе, можно интенсифицировать электроосаждение сплава цинк-никель.
Для стабилизации и перезарядки коллоидных соединений разряжающихся металлов в электролит необходимо вводить специально подобранные органические добавки. Эффективными стабилизаторами коллоидных частиц гидроксида цинка являются катионоактивные водорастворимые полимеры, содержащие структурные фрагменты и функциональные группы –NH2, >NH, >C=S. Стабилизацию коллоидных соединений никеля обеспечивают серосодержащие органические вещества [3].
Учитывая критерии выбора добавок-стабилизаторов, в используемый в промышленности электролит ввели синтезированную нами катионоактивную добавку «ПК-09» в количестве 0,005 г/л. Для устранения питтинга покрытий использовали 0,6 г/л препарата ОС-20. Введение добавок позволило снизить рабочую температуру электролита до 18 – 25 оС. Величина рН 5,5 – 6,0. Рабочий диапазон плотностей тока составил 0,5 – 5,0 А/дм2, что увеличивает скорость процесса в 2,5 раза по сравнению с используемым в промышленности электролитом. Покрытия сплавом, полученные из электролита с добавками, содержат 16 – 24 % никеля. Выход по току сплава 75 – 100 %.
Потенциодинамическими исследованиями электроосаждения сплава цинк-никель в электролите без добавок и с добавками установлено, что на кривых наблюдается два предельных тока (рис. 1). Введение добавок увеличивает катодную поляризацию и снижает величину предельных токов, так как разряд ионов металлов, вероятно, происходит через адсорбционную пленку добавок на катоде.
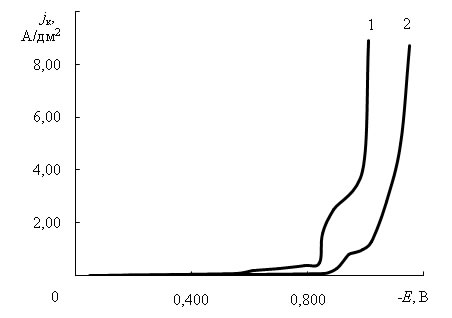
Рис. 1 – Потенциодинамические зависимости выделения сплава цинк-никель в
электролите без добавок (1) и с добавками, г/л: 0,005 «ПК-09» и 0,6 ОС-20 (2)
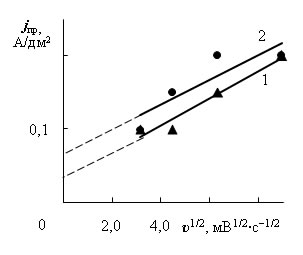
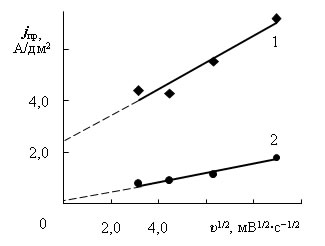
Для исследования природы предельных токов в электролите без добавок получены потенциодинамические зависимости при скорости изменения потенциала 10, 20, 40 и 80 мВ/с (рис. 2). Из зависимостей предельных токов от скорости изменения потенциала υ в степени 1/2 (рис. 3 а и 3 б) следует, что первый предельный ток обусловлен в основном диффузией разряжающихся ионов, однако, зависимость jпр – υ1/2 не проходит через начало координат, а следовательно, существуют кинетические затруднения.
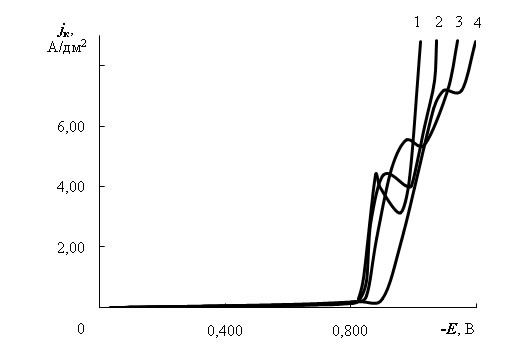
Скорость изменения потенциала, мВ/с: 1 − 10; 2 – 20; 3 – 40; 4 – 80
Рис. 2 – Потенциодинамические зависимости выделения сплава Zn-Ni в исследуемом электролите без добавок
Второй предельный ток также обусловлен смешанной кинетикой. Причем с ростом υ потенциал пика становится более отрицательным, смещаясь от –0,85 до −1,15 В (рис. 2). Это, согласно [4], обусловлено адсорбцией, как мы полагаем, гидроксида цинка или его основных солей.
|
|
|
|
а) зависимости первых предельных токов в электролите без добавок (1) и с добавками (2) |
б) зависимости вторых предельных токов в электролите без добавок (1) и с добавками (2) |
Рис. 3 – Зависимости предельных токов от скорости изменения потенциала в степени 1/2
Вероятно, в области второго предельного тока происходит разряд ионов цинка и никеля через адсорбционную пленку гидроксида цинка, который образуется в прикатодном слое, так как рН гидроксидообразования цинка (рНг) меньше рН прикатодного слоя (рНs), измеренного нами по методике, описанной в [5] (таблица 1).
Таблица 1 − Величины рНг, рНs цинка и никеля и вид предполагаемых их соединений
|
Ионы |
Плотность тока, |
рНг |
рНs |
Предполагаемые соединения |
|
Zn2+ |
1 |
6,14 |
5,7 |
Аквакатионы и комплексные ионы [Zn(NH3)2]2+ |
|
3 |
6,1 |
7,1 |
Аквакатионы, коллоидные соединения на основе Zn(OH)2 и комплексные ионы [Zn(NH3)2]2+, [Zn(NH3)3]2+, [Zn(NH3)2]2+ |
|
|
5 |
6,1 |
7,2 |
Аквакатионы, коллоидные соединения на основе Zn(OH)2 и комплексные ионы [Zn(NH3)2]2+, [Zn(NH3)3]2+, [Zn(NH3)2]2+ |
|
|
Ni2+ |
1 |
7,15 |
5,7 |
Аквакатионы и комплексные ионы [Ni(NH3)2]2+ |
|
3 |
7,15 |
7,1 |
Аквакатионы и комплексные ионы [Ni(NH3)2]2+, [Ni(NH3)3]2+, [Ni(NH3)4]2+, [Ni(NH3)5]2+, [Ni(NH3)6]2+ |
|
|
5 |
7,15 |
7,2 |
Аквакатионы, коллоидные соединения на основе Ni(ОН)2 и комплексные соединения [Ni(NH3)2]2+, [Ni(NH3)3]2+, [Ni(NH3)4]2+, [Ni(NH3)5]2+, [Ni(NH3)6]2+ |
Аналогичные зависимости были получены в электролите с добавками. В присутствии добавок потенциал пика второго предельного тока смещается от –0,84 до –1,03 В. Диффузия и разряд ионов металлов происходит через более плотную адсорбционную пленку гидроксида цинка и добавок на катоде (рис. 3 б).
Помимо коллоидных частиц в процессе разряда принимают участие аммиакатные комплексы цинка и никеля, координационное число которых увеличивается в процессе подщелачивания прикатодного слоя [6] (таблица 1).
С целью ресурсосбережения и экологической безопасности, нами уменьшены концентрации основных компонентов в исследуемом электролите. При снижении концентрации оксида цинка до 10 г/л (8 г/л в пересчете на металл) и концентрации хлорида никеля шестиводного до 60 г/л (15 г/л в пересчете на металл), то есть в 1,5 раза, уже при плотности тока 3 А/дм2 качество осадков ухудшилось, покрытие стало неравномерным, матовым по краям.
Снизить концентрацию ионов цинка в 2 раза (5,7 г/л в пересчете на металл) по сравнению с исследуемым электролитом с добавками и получить полублестящие покрытия сплавом при плотностях тока до 5 А/дм2 позволила замена оксида цинка на сульфат цинка. Это обусловлено, на наш взгляд, возможностью образования в таком электролите большего количества коллоидов, так как помимо выше перечисленных коллоидных соединений (таблица 1) в электролите с сульфатом цинка ядром коллоидных частиц могут быть основные соли цинка ZnSO4∙Zn(OH)2 (рНг 3,8) и никеля 3NiSO4∙4Ni(OH)2 (рНг 5,2) [7]. Стабилизация и перезарядка этих частиц с помощью добавки «ПК-09» позволила достигнуть той же максимально допустимой плотности тока (5 А/дм2), что и при концентрации ионов цинка 12 г/л в электролите с оксидом цинка.
Таким образом, замена оксида цинка на сульфат и введение специально подобранных органических добавок позволило повысить максимально допустимую плотность тока в 2,5 раза по сравнению с промышленной, снизить рабочую температуру до комнатной, а также уменьшить концентрации основных компонентов (в пересчете на металл) в 2 раза, что особенно важно с точки зрения ресурсосбережения и экологической безопасности производства.
Литература:
1. Селиванов В. Н. Электроосаждение металлов из малоконцентрированных электролитов-коллоидов / Юж.-Рос. гос. техн. ун-т. Новочеркасск: ЮРГТУ, 2001. 85 с.
2. Гальванотехника: Справ. изд. /Ф.Ф. Ажогин, М.А. Беленький, И.Е. Галль и др. М.: Металлургия, 1987. 736 с.
3. Бобрикова И. Г. Разработка высокопроизводительных электролитов-коллоидов цинкования: дис. … канд. техн. наук. Новочеркасск, 1988. С. 132–133.
4. Бонд А.М. Полярографические методы в аналитической химии. / Под ред. С.И. Жданова. – М.: Химия, 1983. С. 135−138.
5. Гершов В.М., Пурин Б.А., Озоль-Калнинь Г.А. // Электрохимия. – 1972, Т. 8. С. 1972–1974.
6. В.В. Окулов. Цинкование. Техника и технология. / Под ред. проф. В.Н. Кудрявцева. – М.: Глобус, 2008. 252 с.
7. Ротинян А. Л., Тихонов К. И., Шошина И. А. Теоретическая электрохимия / Под ред. А.Л. Ротиняна. Л.: Химия, 1981. 424 с.