Исследование формирования тригалогенметанов в системе водоснабжения Багдада
Аннотация
Дата поступления статьи: 14.07.2013Хлорирование является наиболее распространенным и фактически безальтернативным методом обеззараживания воды в системе водоснабжения Багдада. В связи с этим возникает вопрос о регулировании содержания тригалогенметанов (ТГМ) в питьевой воде. Исследованиями установлено, что значительная часть ТГМ образуется в процессе транспортировки воды по водопроводным трубам, концентрация ТГМ имеет тенденцию к увеличению в водопроводной распределительной сети по мере удаления от водоочистных станций и имеет выраженную взаимосвязь с количеством остаточного свободного хлора в воде. Показано, что наиболее рациональным способом решения проблемы образования ТГМ в водопроводной сети Багдада является использование диоксида хлора.
Ключевые слова: водопроводная сеть, диоксид хлора, обеззараживание, питьевая вода, система водоснабжения, тригалогенметаны
05.23.04 - Водоснабжение, канализация, строительные системы охраны водных ресурсов
Обеззараживание воды хлором или хлорсодержащими реагентами – наиболее широко распространенный в мире метод обеспечения безопасности питьевой воды в эпидемическом отношении. Преимущества этого метода заключаются в надежности, дешевизне, достаточно высокой эффективности, а также важным эффектом последействия [1, 2]. Эффект последействия, который заключается в поддержании на всем протяжении распределительной сети остаточных количеств дезинфектанта, особенно важен при длительном нахождении воды в водопроводной сети. Повышенные температуры воды (свыше 20 – 25 ºС) также способствуют ускоренному размножению микроорганизмов в водопроводной воде. Именно эти особенности хлорирования делают его фактически безальтернативным методом обеззараживания питьевой воды в Багдаде (Ирак).
Население Багдада составляет около 6 млн. чел, хозяйственно-питьевое водоснабжение города обеспечивается восемью основными водоочистными станциями и рядом малых очистных сооружений. Основным источником водоснабжения Багдада являются поверхностные воды реки Тигр и подземные воды из инфильтрационных водозаборов, находящиеся под сильным влиянием речной воды. Общая производительность всех водоочистных станций (ВОС) – 2 млн. м3/сут; суммарный объем регулирующих и запасных емкостей составляет 1,4 млн. м3, а протяженность водопроводной сети – 8000 км.
На всех ВОС применяется традиционная схема очистки, включающая коагуляцию, флокуляцию (осаждение), фильтрацию и хлорирование. В качестве коагулянта используется сульфат алюминия, а обеззараживающих реагентов – гипохлориты кальция и натрия.
Несмотря на высокую эффективность, хлорирование природной воды связано с образованием многочисленных вторичных загрязнителей – галогенорганических соединений, источниками которых являются природные и антропогенные органические вещества [3, 4]. Основными побочными продуктами хлорирования являются тригалогенметаны – хлороформ или трихлорметан (CHCl3), дихлорбромметан (CHCl2Br), хлордибромметан (CHClBr2) и бромоформ или трибромметан (CHBr3), в совокупности называемые ОТГМ или ТГМ4.
На процессы образования ТГМ в конкретной системе водоснабжения влияет целый ряд различных факторов: сезонное изменение качества воды в источнике, время нахождения воды в резервуарах и водопроводной распределительной сети (т.н. «возраст» воды), температура воды, дозы хлорсодержащих реагентов на очистных сооружениях [4 – 7].
Образование ТГМ продолжается в водопроводной сети, где свободный хлор вступает в реакцию с органическими веществами в воде и на стенках труб. Как правило, при наличии значительного количества остаточного хлора в воде концентрация ТГМ возрастает линейно с увеличением времени [8].
В Ираке содержание ТГМ регулируется Правилами Управления по охране окружающей среды США (EPA – Environmental protection agency). Согласно I этапу Правил максимальная концентрация ТГМ4 не должна превышать 80 мкг/л, а II этапу – 40 мкг/л [9, 10]. В странах Европы установлена величина норматива от 30 до 200 мкг/л, а в России – 60 мкг/л.
Особенность стандартов США заключается в том, что они основываются на усредненных по времени и по точкам отбора величинах концентрации ТГМ, а не на конкретных значениях в отдельно взятых точках водопроводной сети [10]. В связи с этим особо актуальны исследования пространственных и временных факторов трансформации ТГМ в водопроводной воде.
Исследования проводились на двух главных ВОС Багдада: Аль-Карх и Шарк-Дижла, обеспечивающих водой районы Карх и Расафа соответственно, в которых проживает примерно 4 млн. человек или 70 % населения Багдада. Водопроводные сети этих станций не связаны с остальными и вода не смешивается с водой других станций.
Пробы воды отбирались в 29 точках распределительной сети, расположенных на разном удалении от водоочистных станций (точнее – от начальной точки распределительной сети) и на выходе со станций. Непосредственно при отборе проб измерялась температура воды, величина pH и количество остаточного хлора. Анализ хлорорганических соединений проводился в лаборатории исследовательского центра Иорданского университета (Амман) на газовом хроматографе Varian 3800, пробоподготовка осуществлялась методом жидкостной экстракции гексаном.
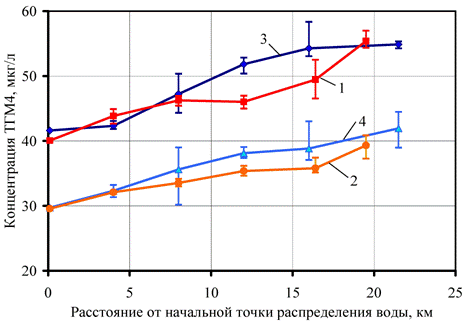
Рис. 1. – Диапазон изменения концентраций ТГМ4 и их средние значения в различных точках распределительной системы Карха (1, 2) и Расафы (3, 4) в летний (1, 3) и зимний периоды (2, 4)
В табл. 1 и на рис. 1 приведены данные о концентрации ТГМ в различных точках двух исследуемых водопроводных систем. Температура водопроводной воды варьировалась от 18,5 ºС в начальной точке до 22 ºС в конечных пунктах зимой и соответственно от 30 до 32,5 ºС летом. Из приведенных данных видно, что в зимний период значения концентраций ТГМ4 не превышают норматив 40 мкг/л, указанный во II этапе Правил [10], исключение составляют самые удаленные точки системы Расафы, а в летний период наблюдается превышение во всех точках сети. Норматив 80 мкг/л, указанный во I этапе Правил [9], соблюдался во все сезоны года.
Таблица № 1
Концентрация ТГМ4 (мкг/л) в различных точках распределительной системы районов Карха и Расафы
Распределительная система Карха |
||||
|
Расстояние от ВОС, км |
Лето (август 2006 г.) |
Зима (февраль 2007 г.) |
||
|
среднее значение |
минимальное / |
среднее значение |
минимальное / |
|
|
начальная точка |
40,06 |
– |
29,57 |
– |
|
4 (5) |
43,85 ± 0,91 |
42,65 / 44,89 |
32,09 ± 0,23 |
31,79 / 32,34 |
|
8 (7) |
46,26 ± 0,50 |
45,41 / 46,93 |
33,52 ± 0,44 |
32,97 / 34,14 |
|
12 (5) |
46,02 ± 0,90 |
44,98 / 46,96 |
35,37 ± 0,61 |
34,63 / 36,15 |
|
15-17,8 (8) |
49,44 ± 2,37 |
46,53 / 52,49 |
35,80 ± 0,75 |
35,14 / 37,41 |
|
18-21 (4) |
55,38 ± 0,98 |
54,34 / 56,97 |
39,31 ± 1,39 |
37,26 / 40,85 |
|
Вся сеть |
47,87 |
42,65 / 56,97 |
35,51 |
31,79 / 40,85 |
|
Распределительная система Расафы |
||||
|
Расстояние от ВОС, км |
Лето (август 2006 г.) |
Зима (февраль 2007 г.) |
||
|
среднее значение |
минимальное / |
среднее значение |
минимальное / |
|
|
начальная точка |
41,61 |
– |
29,72 |
– |
|
4 (5) |
42,32 ± 0,49 |
41,83 / 43,06 |
32,32 ± 0,77 |
31,33 / 33,21 |
|
8 (7) |
47,23 ± 2,48 |
44,32 / 50,34 |
35,62 ± 2,99 |
30,17 / 39,00 |
|
12 (5) |
51,82 ± 0,91 |
50,36 / 52,83 |
38,12 ± 0,75 |
37,36 / 39,05 |
|
16 (7) |
54,27 ± 1,94 |
53,05 / 58,33 |
38,83 ± 1,92 |
37,06 / 43,01 |
|
20-23 (5) |
54,87 ± 0,45 |
54,26 / 55,32 |
41,94 ± 2,21 |
38,95 / 44,47 |
|
Вся сеть |
50,17 |
41,83 / 58,33 |
37,15 |
30,17 / 44,47 |
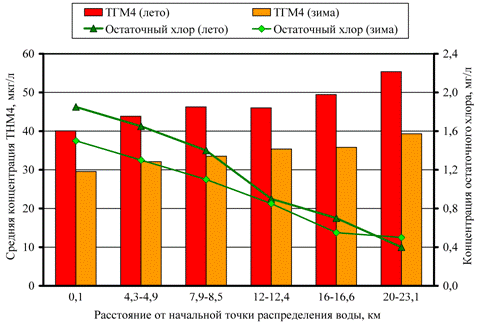
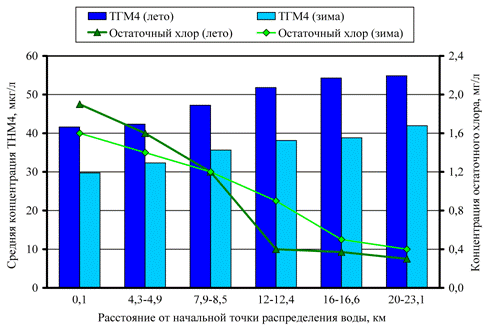
На рис. 2 представлены зависимости концентрации ТГМ4 и остаточного хлора от расстояния между местом взятия пробы и водоочистной станцией для водопроводных систем Расафы и Аль-Карха. Расстояние от водоочистной станции не связано напрямую со временем пребывания воды в сети и, соответственно, со временем контакта хлора с органическим веществом, поэтому для определения «возраста» воды была выбрана величина остаточного хлора в водопроводной воде [11].
а)
б)
Рис. 2. – Зависимость концентрации ТГМ4 и остаточного хлора от расстояния между начальной точкой распределения воды и конечным пунктом распределения (летом и зимой): а – Карх; б – Расафа
Во все сезоны года наблюдается увеличение концентрации ТГМ4 с уменьшением концентрации остаточного хлора по мере удаления от начальной точки распределения воды и увеличением времени контакта свободного хлора с органическим веществом, что подкрепляется и теоретическими исследованиями [12]. В среднем около 30 – 38 % от общего уровня ТГМ4 образуется в процессе движения воды по водопроводной сети.
В летнее время наблюдается более высокий уровень ТГМ, так как при более высокой температуре скорость взаимодействия свободного хлора с органическим веществом возрастает. Скорость роста концентрации ТГМ4 летом также была выше (в 1,3-1,4 раза), чем зимой. Существенное значение для формирования ТГМ имеет доза хлора, которую в теплое время года обычно повышают из-за повышенного риска повторного микробиологического загрязнения воды. Исследования показывают, что количество образующихся хлорорганических соединений прямо пропорционально дозе введенного хлора [6, 13]. Эта тенденция наблюдается и для рассматриваемых водоочистных станций Багдада: повышение дозы хлора летом на 20 % сразу отразилось на уровне ТГМ в начале сети. Коэффициент корреляции между количеством остаточного хлора и концентрацией ТГМ4 составил -0,83…-0,98.
На рис. 3 приведены данные о концентрации четырех основных хлорорганических соединений (CHCl3, CHCl2Br, CHBr2Cl, CHBr3) в водопроводной системе Карха, а на рис. 4 – средние значения концентрации основных хлорорганических соединений для всех исследованных ВОС. Из графиков видно, что процент соединений брома (CHCl2Br, CHBr2Cl и CHBr3) составляет около трех четвертых от общего количества хлорорганических соединений. Скорее всего, это обусловлено наличием бромидов в источниках воды, что способствует повышению концентрации бромированных соединений ТГМ на всех очистных станциях Багдада, и наиболее высокая она в Кархе [14].
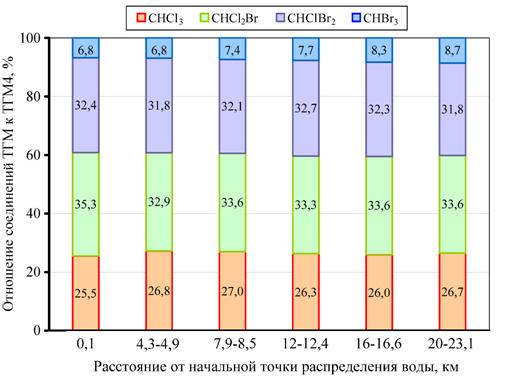
Рис. 3. – Изменение содержания основных хлорорганических соединений в летний период в зависимости от расстояния между начальной точкой распределения воды и конечным пунктом распределения в системе Карха
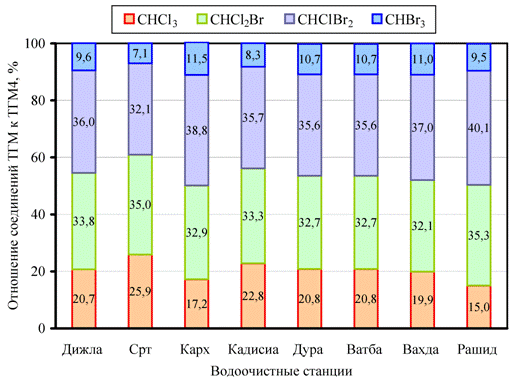
Рис. 4. – Изменение содержания основных хлорорганических соединений на всех исследованных ВОС в летний период
Основным источником образования галогенорганических соединений в хлорированной питьевой воде являются содержащиеся в ней органические вещества. Одним из эффективных методов снижения образования тригалогенметанов в процессе хлорирования является удаление органических компонентов из воды на начальной стадии водоочистки. Однако наибольшее количество хлорорганических соединений образуется в воде при первичном хлорировании, до удаления из нее загрязнений. Поэтому традиционные методы решения проблемы повышенного содержания ТГМ в питьевой воде заключаются в замене хлорирования на озонирование и в применении сорбционной обработки воды. Однако, недостатком озоно-сорбционной технологии являются высокие затраты на ее реализацию, как капитальные, так и эксплуатационные.
В настоящее время разрабатываются новые способы дезинфекции воды, основанные на сочетании ультразвуковой и кавитационной обработки воды с ультрафиолетом или озоном, применении электрических разрядов и т.п. [15]. Так, китайскими учеными разработан фотохимический катализатор с наночастицами палладия, который при воздействии даже обычного света обладает чрезвычайно высоким эффектом обеззараживания [16]. К сожалению, все эти методы не обладают последействием, что накладывает ограничения на область их применения. Редким исключением здесь являются препараты на основе полигексаметиленгуанидина гидрохлорида – биоциды неокислительного действия, сохраняющие свою эффективность в течение длительного времени [17].
Одним из эффективных решений проблемы образования ТГМ может стать применение диоксида хлора. Диоксид хлора (ClO2) используется в области подготовки воды для ее дезинфекции при одновременном осуществлении окислительных процессов. При растворении в воде диоксида хлора образуются хлористая (HClO2) и хлорноватая (HClO3) кислоты. Хлораты (ClO3–) обладают сильной окислительной способностью, в несколько раз превышающей окислительную способность хлорноватистой кислоты (HClO) и гипохлорит-ионов, образующихся в воде использовании жидкого хлора и гипохлоритов натрия или кальция.
Применение диоксида хлора практически полностью исключает образование тригалогенметанов [18]. Это обусловлено тем, что при наличии диоксида хлора в питьевой воде не протекают реакции хлорирования. Вещества, вызывающие неприятный запах и вкус воды, например, фенолы и продукты их распада, окисляются диоксидом хлора и преобразуются в нейтральные по вкусу и запаху вещества, что существенно повышает качество питьевой воды.
Скорость уничтожения микроорганизмов диоксидом хлора возрастает с увеличением показателя pH. Диоксид хлора не вступает в реакцию с аммонием и его соединениями. Это существенное отличие от гипохлоритов, которые образуют с аммонием хлорамины, оказывающие отрицательное влияние на дезинфекцию и вкус обрабатываемой воды.
Диоксид хлора очень устойчив в воде. После окончания поглощения избыток сохраняется длительное время, что важно в условиях обширной сети трубопроводов и резервуаров для эффективного предотвращения повторного загрязнения воды.
В табл. 2 приведены результаты сравнения обработки воды реки Тигр гипохлоритом кальция и диоксидом хлора. Исследования проводились при максимальной возможной дозировке – 0,4 мг/л, при которой диоксид хлора образует побочные продукты окисления в безопасных количествах [18].
Таблица 3
Образование тригалогенметанов при обеззараживании воды гипохлоритом кальция и диоксидом хлора
Тригалогенметаны |
Концентрация тригалогенметанов, мг/л |
|
|
гипохлорит кальция |
диоксид хлора |
|
|
Хлороформ |
0,384 |
0,0176 |
|
Бромоформ |
0,516 |
0,0286 |
|
Бромдихлорметан |
0,284 |
0,0105 |
|
Дибромхлорметан |
0,312 |
0,0178 |
Учитывая особенности физических и физико-химических свойств, диоксид хлора готовится только в форме водных растворов в месте использования с применением специального аппаратурного оформления. Диоксид хлора производится из хлорита натрия (NaClO2) и хлора (Cl2) или из хлорита натрия и кислоты, преимущественно соляной.
Максимальный показатель остаточного количества дезинфектанта в обработанной воде составляет по российским нормативам для хлорита 0,2 мг/л [19] и 0,8 мг/л – для диоксида хлора по нормативам США [9].
Выводы
1. Изучение трансформации ТГМ в водопроводной воде Багдада показало, что до 38 % от общего содержания ТГМ образуется в процессе транспортировки воды по водопроводным трубам. Для двух водоочистных станций наблюдалась приблизительно одинаковая картина образования ТГМ4, причем летом скорость роста ТГМ4 в водопроводной сети была в 1,3 – 1,4 раза выше чем зимой, а концентрация – на треть больше. Концентрация ТГМ4 увеличивается по мере удаления от начальной точки распределения воды и имеет выраженную взаимосвязь с количеством остаточного свободного хлора.
2. Летом общая концентрация ТГМ4 в водопроводной сети превышала предел в 40 мкг/л, указанный в этапе II Правил, установленных Управлением по охране окружающей среды США.
3. Наибольший процент от общего содержания ТГМ составили соединения брома (73 – 80 %), что может быть связано с содержанием бромидов в источнике.
4. Одним из эффективных путей решения проблемы образования ТГМ является замена дезинфицирующего агента на диоксид хлора. При небольших дозах диоксида хлора (до 0,4 мг/л) концентрация образующихся хлорорганических соединений снижается более чем на порядок по сравнению с применением гипохлоритов.
Список литературы:
1. Гончарук В.В., Потапченко Н.Г. Современное состояние проблемы обеззараживания воды [Текст] // Химия и технология воды, 1998. – Т. 20, № 2. – С. 119-217.
2. Baxter G. Chlorine disinfection: The industry standard [Текст] // J. Water Supply, 1995. – Vol. 13, No. 2. – Р. 183-193.
3. Известкова, Т.В. Хлорорганические поллютанты в природном источнике водоснабжения и питьевой воды г. Иванова [Текст] / Т.В. Известкова, В.И. Гриневич, В.В. Костров // Инженерная геология, 2003. – № 3. – С. 49-54.
4. Symons, J.M. Factors affecting disinfection by-product formation during chloramination [Текст] / J.M. Symons, R. Xia, G.E.Jr. Speitel, A.C. Diehl, C.J. Hwang, S.W. Krasner, S.E. Barrett. Report No. 90728 – American Water Works Association Research Foundation, Denver, CO, 1998.
5. Brett R.W., Ridgeway J.W. Experiences with chlorine dioxide in southern water authority and water research center [Текст] // J. IWES, 1981. – Vol. 5, No.2. – Р. 23-32.
6. Прокопов Э.Д., Мактаз Г.В. Влияние отдельных факторов на образование тригалогенметанов в хлорированной воде [Текст] // Химия и технология воды, 1993. – Т. 15, № 9. – С. 633-640.
7. Singer P.C. Control of disinfection by-products in drinking water [Текст] // J. of Environmental Engineering, 1994. – V. 120, No. 4. – P. 727-744.
8. Garcia-Villanova, J. Formation, evaluation and modeling of trihalomethanes in the drinking water of a town: II. In the distribution system [Текст] / J. Garcia-Villanova, C. Garcia, J.A. Gomea, M.P. Garcia, R. Ardanuy // J. Water Research, 1997. – Vol. 31, No. 6. – P. 1405-1413.
9. National Primary Drinking Water Regulations: Disinfectants and Disinfection Byproducts (Stage 1 Disinfectant and Disinfection Byproduct Rule). Environmental protection agency [Текст] // Federal Register, 1998. – Vol. 63, No. 241. – P. 69389-69476.
10. National Primary Drinking Water Regulations: Stage 2 Disinfectants and Disinfection Byproducts Rule. Environmental protection agency [Текст] // Federal Register, 2006. – Vol. 71, No. 2. – P. 388-493.
11. Brett R.W., Calverley R.A. A one-year survey of trihalomethane concentration changes within a distribution system [Текст] // J. AWWA, 1979. – Vol. 71, No. 9. – P. 515-520.
12. Tokmak, B. Trihalomethanes and associated potential cancer risks in the water supply in Ankara, Turkey [Текст] / B. Tokmak, G. Cpar, F.B. Dilek, U. Yetis // J. Environmental Research, 2004. – Vol. 96, No. 11. – P. 345-352.
13. Коверга, А.В. Снижение содержания хлорорганических соединений на московских станциях водоподготовки [Текст] / А.В. Коверга, О.Е. Благова, Ю.В. Стрихар // Водоснабжение и сан. техника, 2009. – № 10, Ч. 1. – С. 39-42.
14. Symons, J.M. The influence of bromide ion on organic bromine formation during free chlorination [Текст] / J.M. Symons, P.L.K. Fu, R.C. Dressman, A.A. Stevens // J. AWWA, 1987. – Vol. 79, No. 9. – P. 114-118.
15. Серпокрылов, Н.С. Очистка сточных вод бассейнов для содержания ластоногих до норм оборотного водоснабжения [Электронный ресурс] / Н.С. Серпокрылов, С.В. Кожин, Е.А. Тайвер // «Инженерный вестник Дона», 2011, №1. – Режим доступа: http://ivdon.ru/magazine/archive/n1y2011/380 (доступ свободный) – Загл. с экрана. – Яз. рус.
16. Фиговский Олег. Что день грядущий нам готовит? [Электронный ресурс] // «Инженерный вестник Дона», 2011, №1. – Режим доступа: http://ivdon.ru/magazine/archive/n1y2011/396 (доступ свободный) – Загл. с экрана. – Яз. рус.
17. Воинцева И.И. Полигексаметиленгуанидин гидрохлорид для очистки и обеззараживания воды как альтернатива реагентам-окислителям Часть 1 // Вода: химия и экология, 2011. – № 7. – С. 39-45.
18. Arora, H. DBP occurrence survey [Текст] / H. Arora, M.W. LeChevallier, L. Kelvin // J. AWWA, 1997. – Vol. 89, No. 6. – P. 60-68.
19. СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Санитарные правила и нормы [Текст]. – взамен СанПиН 2.1.4.559-96; введ. 2002–01–01 – М.: Технорматив, 2010. – 75 с.